2020年2月13日,同济大学附属同济医院梁爱斌课题组与上海交通大学医学院附属瑞金医院胡炯课题组合作在blood上发表题为“flt3 inhibition upregulates hdac8 via foxo to inactivate p53 and promote maintenance of flt3-itd+ acute myeloid leukemia”的文章,发现了hdac8维持flt3-itd+ aml白血病干细胞稳定性和抵抗flt3抑制剂的分子机制,以及靶向hdac8治疗flt3-itd+ aml的潜在新策略。
我国急性髓系白血病(aml)的发生率约为 2.3/10 万人,其中 flt3 内部串联重复突变(flt3-itd)出现于约 25%的 aml 患者,引起 aml 预后不良:导致 aml 复发风险增加(复发率达 80%,不含 flt3-itd 突变 aml 患者的复发率约为 30%)和总体生存率更低(5 年总生存率约为 25%,不含 flt3-itd 突变 aml 患者 的 5 年总生存率约为 45%)1 。
因此,flt3-itd+ aml 的治疗是血液肿瘤领域的热点问题。梁爱斌团队的这项研究为 flt3-itd+ aml 患者的治疗带来了新的曙光,有望成为这一类型 aml 治疗的新方案。
目前针对flt3-itd已有数种酪氨酸激酶抑制剂,如midostaurin、gilteritinib、quizartinib等2。这些抑制剂在临床实践中展现出良好的治疗反应,并在一定程度上改善了aml患者的预后。
但是flt3抑制剂的耐药性,却是导致其临床效果不佳的原因,尤其是作为单一疗法使用时,疾病很快复发。组蛋白去乙酰化酶(histone deacetylases,hdacs)可从蛋白质上赖氨酸残基的ε-氨基脱去乙酰基团,其底物包括组蛋白和非组蛋白。
在多种类型肿瘤,尤其是白血病中,存在hdacs异常表达或被致癌蛋白异常招募的现象3。hdacs异常引起基因异常转录及蛋白功能紊乱,调控白血病干细胞的干性维持,从而抵抗多种治疗手段。
2017年梁爱斌课题组与胡炯课题组合作在leukemia杂志上报道化疗药物能引起aml细胞中hdac3表达上调4。上调的hdac3能去乙酰化akt并促进后者活化,进而增强aml细胞的dna损伤修复能力,维持aml基因组的稳定,引起对化疗抵抗。
靶向抑制hdac3能增加化疗药物对aml的杀伤,逆转aml细胞化疗耐药。由于临床上针对flt3-itd+ aml常采用化疗和flt3抑制剂联合疗法,而hdacs在flt3抑制剂耐药中所起作用尚不清楚。
基于此,梁爱斌课题组和胡炯课题组再度合作,于2020年4月23日在blood杂志正式发表题为flt3 inhibition upregulates hdac8 via foxo to inactivate p53 and promote maintenance of flt3-itd+ acute myeloid leukemia的文章,发现了hdac8维持flt3-itd+ aml白血病干细胞稳定性和抵抗flt3抑制剂的分子机制,以及靶向hdac8治疗flt3-itd+ aml的潜在新策略。

通过利用两种含有flt3-itd突变的aml细胞株以及病人原代aml细胞,研究团队发现抑制flt3可导致hdac8上调。之前已经有多项研究证明hdac8的异常表达与多种肿瘤的不良预后相关。
靶向抑制hdac8结合flt3抑制剂治疗可增加flt3-itd+ aml的死亡,并延长移植了flt3-itd+ aml细胞系的nod-scid小鼠的生存期。对用hdac8特异性抑制剂处理的flt3-itd+ aml细胞进行基因表达分析显示p53信号通路显著上调。相反,敲低p53能阻止hdac8和/或flt3抑制剂所诱导的flt3-itd+ aml细胞凋亡。研究人员进一步证实hdac8表达增加是由于转录增强所致,转录因子foxo1/3在上调hdac8和促进对flt3抑制剂抵抗中起着关键作用。
最后,研究人员建立了flt3-itd+ aml pdx模型,并利用pdx模型证实hdac8和flt3抑制剂联合治疗具有更显著的疗效,二次移植实验更是证明抑制hdac8可以靶向白血病干细胞,降低白血病起始能力。此外,研究人员还证明在kit突变的aml中,同时靶向hdac8和kit也可能具有优异的疗效。
综上所述,该研究提出了上调hdac8对酪氨酸激酶抑制剂耐药的新机制。flt3抑制后可通过foxo1/3引起hdac8转录增加,进而抑制aml细胞中p53的活性,从而在酪氨酸激酶抑制剂治疗后促进白血病维持和耐药性。本研究为酪氨酸激酶突变的肿瘤治疗提供了新策略。也为临床上联合应用flt3抑制剂和hdac抑制剂治疗flt3-itd+ aml提供了实验依据。目前相关的临床试验正在计划开展中。
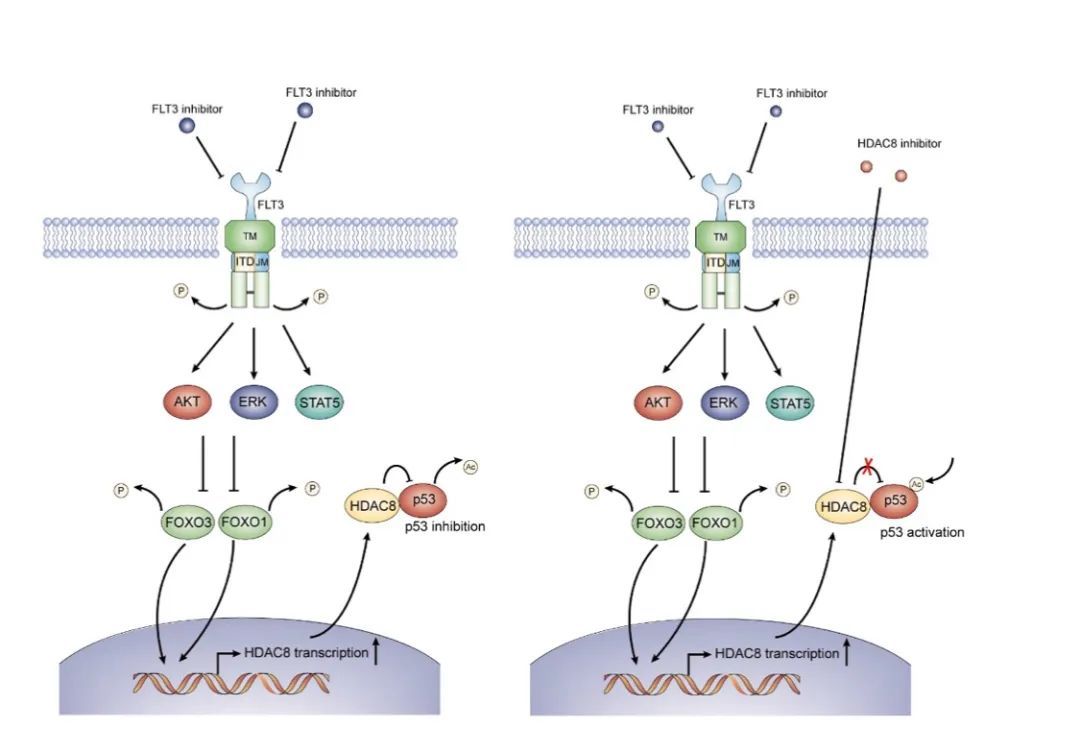
双靶向flt3和hdac8的分子机制模式图
blood杂志非常重视该文章的发表,特别邀请daniela s. krause教授在同期发表对本研究的评述。
daniela s. krause教授认为,该文章发现了foxo1/3-hdac8-p53介导的信号通路在flt3-itd+ aml白血病干细胞稳定性和flt3抑制剂耐药的作用机制。

同济大学附属同济医院博士研究生龙俊为本文的第一作者,上海交通大学医学院附属瑞金医院硕士研究生贾明愿、方玮玥和陈欣洁医生为本文的共同第一作者。
参考文献:
1.short nj, rytting me, cortes je. acute myeloid leukaemia. lancet. 2018;392(10147):593-606.
2.daver n, kantarjian h. flt3 inhibition in acute myeloid leukaemia. lancet oncol. 2017;18(8):988-989.
3.west ac, johnstone rw. new and emerging hdac inhibitors for cancer treatment. j clin invest. 2014;124(1):30-39.
4.long j, fang wy, chang l, et al. targeting hdac3, a new partner protein of akt in the reversal of chemoresistance in acute myeloid leukemia via dna damage response. leukemia. 2017;31(12):2761-2770.
文 | 宣传处
编辑丨宣传处
上观号作者:同济大学附属同济医院
